Differenza tra gli elementi di blocco D e gli elementi di transizione | D Elementi di blocco vs Elementi di transizione
Differenza di chiave - Elementi di blocco D vs elementi di transizione
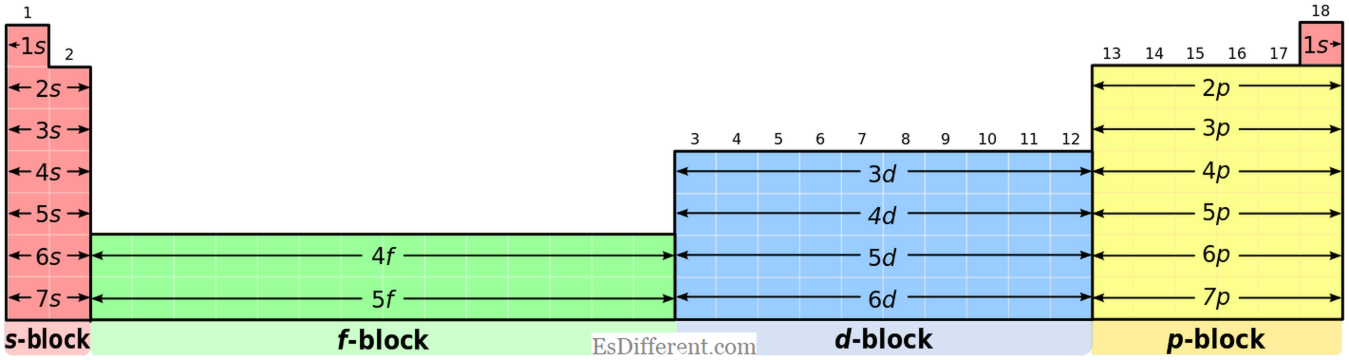
La differenza tra gli elementi a blocco D e la transizione elementi è abbastanza confusa. Entrambe le parole vengono utilizzate in modo intercambiabile, e molte persone usano la parola 'elementi di transizione' per gli elementi a d-block. , non tutti gli elementi a blocchi D sono elementi di transizione . È chiaro che gli elementi a d-block dispongono di d-elettroni nella shell d-sub. Elementi di transizione sono gli elementi che formano ioni stabili che hanno d -orbitali incompletamente riempiti. Ad esempio, lo zinco e lo scandio sono elementi d-block; ma non elementi di transizione. Che cosa sono gli elementi di blocco D 999? Gli elementi a blocchi D possono essere identificati chiaramente utilizzando la configurazione dell'elettrone e la posizione della tabella periodica. La caratteristica principale dell'elemento d-block è quella di avere almeno un elettrone nella shell sub d-
. La cosa strana accade quando il riempimento di elettroni secondo il principioAufbau negli elementi a d-block è, per prima cosa, prima di

3d -elettronici; il che significa che gli elctroni 3d hanno una energia superiore a 4s-elettroni. Ma quando rimuovono gli elettroni per formare ioni; 4s -elettroni vengono prima rimossi dall'atomo.
| 2 | 4s | |
| 2 | Vanadium | V [Ar] 3d 3 4s |
| 2 | Cromo Cr [Ar] 3d 5 | |
| 4s | 1 | Manganese Mn [Ar] 3d 5 |
| 4s | 2 | Ferroso Fe [Ar] 3d 6 |
| 4s | 2 | Cobalto Co 4s |
| 2 | Nichel | Ni [Ar] 3d 8 4s |
| 2 | 10 4s 1 Zinco | |
| Zn | [Ar] 3d | 10 4s 2 |
| 2 | 2p | 6 3s 2 2s |
| 2 | Nota: | 3p 6 Quali sono gli elementi di transizione? Elementi di transizione sono gli elementi che formano ioni stabili con d-orbitali incompletamente riempiti. Quando gli ioni sono formati da elementi a d-block; prima eliminano i |
-elettronici (livello n) e quindi rimuovono d -elettronici (livello n-1). Lo zinco e lo scandio sono due elementi speciali nel blocco d; non formano ioni che hanno incompletamente riempiti d -orbitali; pertanto non sono considerati elementi di transizione.Tutti gli altri elementi del gruppo d formano ioni stabili i cui elettroni sono pieni di d . Transition Metal Solutions Qual è la differenza tra gli elementi a blocchi e gli elementi di transizione? Gli elementi con uno o più d-
elettroni nella shell sub
d- Definizione di Elementi di D-Block e Elementi di Transizione sono conosciuti come elementi d-block. La maggior parte degli elementi d-block sono metalli. Elementi di transizione: Gli elementi che possono formare ioni stabili con orbitali incompleti d vengono chiamati elementi di transizione. Nota:

Zn e Sc non sono elementi di transizione. Essi non formano solo gli ioni Zn
2+
e Sc
3+ , che non contengono d-orbitali non completi. Zn 2+ = 1s 2
2s 2 2p 6
3s
2 3p 6 3d 10
Sc 3+ = 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10
I seguenti ioni contengono d-orbitali non completi. Pertanto, questi elementi sono considerati elementi di transizione. 2s 2 2s 2 2p 6 3s 2 3p 6 3 2 2s
2
2p 6 3s 2 9 3p 6 3d 6 Mn 2+ = 1s 2
2s 2 2p 6 3s 2 3p 6 3d 5 Fe 2+ = 1s 2
2s 2 2p 6 3s 2 3p 6 3d 6 Stati di ossidazione: D-Block elements: degli elementi a D-block mostrano stati multipli di ossidazione e pochi di essi mostrano un solo stato di ossidazione. Esempio:
Lo zinco mostra solo lo stato di ossidazione +2 e lo Scandium mostra solo lo stato di ossidazione +3. Altri elementi del d-block mostrano stati multipli di ossidazione. Elementi di transizione: Gli elementi di transizione mostrano più stati di ossidazione. Almeno un solo stato contiene non completati d -orbitali. Esempio: Titanio +2, +4 Vanadium +2, +3, +4, +5 Cromo +2, +3, +6 Manganese +2, +3, +4, +6, +7 Ferroso +2, +3 Cobalto +2, +3 Nichel +2, +4
Rame +1, +2
Immagine gentilmente concessa: 1. "Blocchi periodici della tabella spdf (32 colonne)" da Utente: DePiep [CC BY-SA 3. 0] via Commons
2. "Soluzioni metalliche di transizione colorate" [Public Domain] via Commons




