Differenza tra composti ionici e covalenti | Ioni vs Compiti Covalenti
Differenze chiave - composti ionici vs covalenti
Molte differenze possono essere osservate tra composti ionici e covalenti in base alle loro proprietà macroscopiche come la solubilità in acqua, conduttività elettrica, punti di fusione e punti di ebollizione. La ragione principale di queste differenze è la differenza nel loro modello di legame. Pertanto, il loro modello di legame può essere considerato come la differenza di chiave tra composti ionici e covalenti. (Differenza tra legami ionici e covalenti) Quando si formano legami ionici, gli elettroni vengono donati da un metallo e gli elettroni donati sono accettati da un metallo non metallico. Essi formano un forte legame grazie all'attrazione elettrostatica. I legami covalenti si formano tra due non metalli. Nel legame covalente, due o più atomi condividono gli elettroni per soddisfare la regola ottetica. Generalmente, i legami ionici sono più forti dei legami covalenti. Ciò porta alle differenze nelle loro proprietà fisiche.
Quali sono i composti ionici?
I legami ionici si formano quando due atomi hanno una grande differenza nei loro valori di electronegativity. Nel processo di formazione di legame, le atomizzazioni meno atroide elettroniche e gli atomi più elettronegativi ottengono gli elettroni (s). Pertanto, le specie risultanti sono ioni opposti e formano un legame a causa della forte attrazione elettrostatica.
I legami ionici sono formati tra metalli e non metalli. In generale, i metalli non hanno molti elettroni di valenza nel guscio più esterno; tuttavia, i metalli non hanno più vicino a otto elettroni nella shell di valenza. Pertanto, i non-metalli tendono ad accettare gli elettroni per soddisfare la norma di ottetto.
Esempio di composto ionico è Na + + Cl - à NaCl
Il sodio (metallo) ha solo un elettrovalenza e il cloro (non metallico) sette elettroni di valenza.

Quali sono i composti covalenti?
I composti covalenti vengono formati condividendo gli elettroni tra due o più atomi per soddisfare la "norma di ottetto". Questo tipo di legame si trova comunemente nei composti non metallici, negli atomi dello stesso composto o negli elementi vicini nella tabella periodica. Due atomi aventi quasi i medesimi valori di electronegativity non scambiano (donano / ricevono) gli elettroni dalla loro shell di valenza. Al contrario, condividono gli elettroni per raggiungere la configurazione ottetta.
Esempi di composti covalenti sono il metano (CH 4 ), il monossido di carbonio (CO), il monobromuro di iodio (IBr)
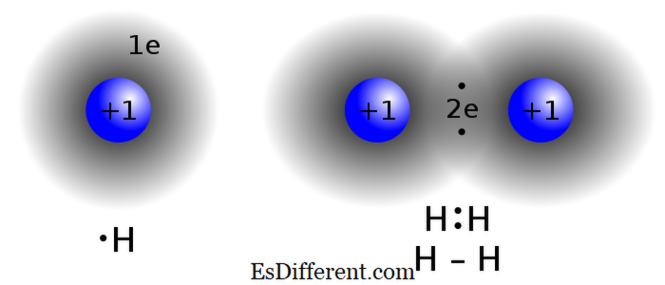
il legame covalente
Qual è la differenza tra ionico e covalente Composti?
Definizione di composti ionici e composti covalenti
Composto ionico: Il composto ionico è un composto chimico di cationi e anioni che sono tenuti insieme da legami ionici in una struttura reticolare.
Composto covalente: Il composto covalente è un legame chimico formato dalla condivisione di uno o più elettroni, in particolare coppie di elettroni, tra gli atomi.
Proprietà dei composti ionici e covalenti
Proprietà fisiche
Composti ionici:
Tutti i composti ionici esistono come solidi a temperatura ambiente.
I composti ionici hanno una struttura cristallina stabile. Pertanto, hanno punti di fusione più elevati e punti di ebollizione. Le forze di attrazione tra gli ioni positivi e negativi sono molto forti.
| Liquido cristallino bianco | 801 ° C | KCl - Cloruro di potassio |
| Cristallo vitreo bianco o incolore | 770 ° C | MgCl |
| 2 | - Cloruro di magnesio | Solido cristallino bianco o incolore |
| 1412 ° C Composti covalenti: I composti covalenti esistono in tutte e tre le forme; come solidi, liquidi e gas a temperatura ambiente. I loro punti di fusione e di ebollizione sono relativamente bassi rispetto ai composti ionici. | Composti covalenti | Aspetto |
Punto di fusione
HCl-Cloruro di idrogeno
Un gas incolore
| -114. | -182 ° C | CCl |
| 4 | - Tetracloruro di carbonio | Un liquido incolore |
| -23 ° C Conducibilità Composti ionici: | I composti ionici solidi non hanno elettroni liberi; pertanto, non conducono elettricità in forma solida. Ma, quando i composti ionici vengono sciolti in acqua, fanno una soluzione che conduce l'elettricità. In altre parole, soluzioni acquose di composti ionici sono buoni conduttori elettrici. | Composti covalenti: |
| Nessun composto covalente puro, né le forme disciolte in acqua, non conducono elettricità. Pertanto, i composti covalenti sono conduttori elettrici scarsi in tutte le fasi. Solubilità Composti ionici: | La maggior parte dei composti ionici sono solubili in acqua, ma sono insolubili in solventi non polari. | Composti covalenti: |
La maggior parte dei composti covalenti sono solubili in solventi non polari, ma non in acqua.
Durezza Composti ionici:
I solidi ionici sono composti più duri e fragili. Composti covalenti:
In generale, i composti covalenti sono più morbidi dei solidi ionici.
Immagine per gentile concessione: "Idrogeno legame covalente" di Jacek FH - Lavoro personale. (CC BY-SA 3. 0) via Commons "IonicBondingRH11" di Rhannosh - Lavoro personale. (CC BY-SA 3. 0) tramite Wikimedia Commons


