Differenza tra titolazione a base di acido e titolazione di Redox | Titolazione Acid-Base vs Titolazione Redox
differenza chiave - titolazione a base di acido-titolazione a redox
le titolazioni vengono utilizzate per determinare la concentrazione di una soluzione sconosciuta (analita). I metodi titrimetrici più comunemente usati sono titolazioni di acido-base e titolazioni redox. La differenza tra le titolazioni di acido-base e le titolazioni redox è la natura della reazione che avviene tra il titolante e l'analto nella titolazione. Nelle titolazioni a base di acido-base si ha una reazione di neutralizzazione e nelle titolazioni redox si ha una reazione redox (una reazione ossidante e una reazione di riduzione). L'utilizzo di indicatori è il metodo più comunemente utilizzato per determinare l'endpoint della reazione.
Che cosa è una titolazione di acido-base?
In titolazioni a base di acido, si usa come titrante un acido (titolazioni acide) o una base (titolazioni di base). Esempi di acidi utilizzati nelle titolazioni acide sono H 2 SO 4 , HCl o HNO 3. I titranti di base più utilizzati sono NaOH, K 2 CO 3 o Na 2 CO 3. Le titolazioni di acido-base possono essere classificate come segue a seconda della resistenza dell'acido e della base.
- Acidi forti - basse titolazioni di base
- Acidi deboli - titolazioni basse della base
- In gran parte dell'acido - le titolazioni di base, vengono utilizzati indicatori per determinare il punto finale della reazione. Diversi indicatori vengono utilizzati a seconda del tipo di titolazione come sopra indicato.
Che cos'è una titolazione di Redox?
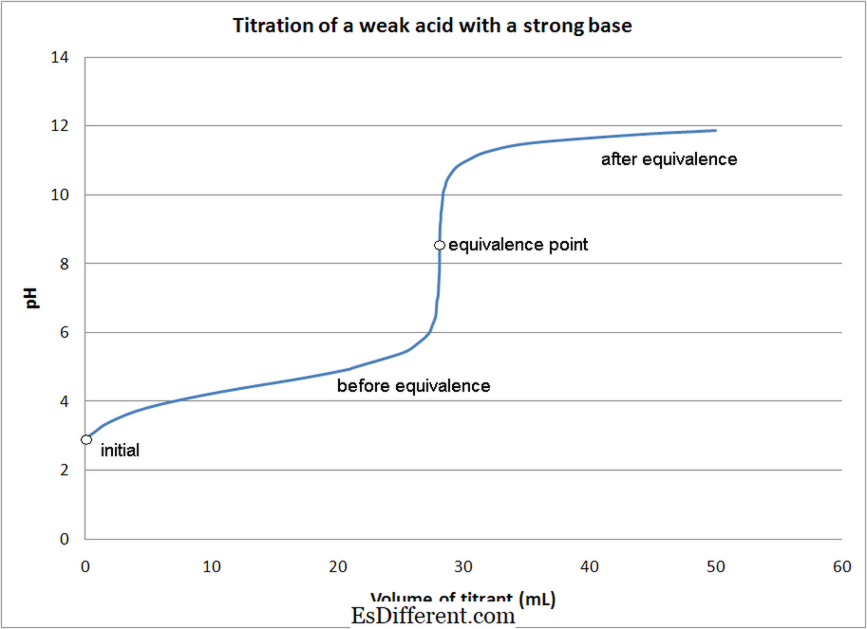
Qual è la differenza tra Titration Acid-Base e Titration Redox?
Natura della reazione:

Titolazione a base di acido:
Una titolazione con acido-base comporta una reazione di neutralizzazione tra l'analita (la soluzione con la concentrazione sconosciuta) e il titolatore acido o base.
Titolazione Redox: Una reazione redox comporta una reazione di ossidazione e riduzione tra l'analita e il titolante. Non esiste una regola tale che la componente si ossida e quale si riduce. L'analizzatore o il titolante ossidano e il componente rimanente diminuisce di conseguenza.
Determinazione del punto finale: Titolazione a base di acido:
In generale, viene utilizzato un indicatore pH, un misuratore di pH o uno strumento di conducibilità per determinare il punto finale di una titolazione a base di acido-base.
Titolazione Redox: I metodi più comunemente usati per determinare il punto finale di una reazione redox utilizzano un potenziometro o un indicatore di redox. Tuttavia, più spesso l'analita o il titolante producono un colore all'estremità. Quindi, in questi casi non sono necessari ulteriori indicatori.
Esempi: Titolazione Acid-Base:
Tipo
Reazione (Indicatore)| Titolazione a base di acido forte e forte | HCl + NaOHàNaCl + H |
| 2 | O (fenolftaleina / metil Acido acido - titolazione basica debole HCl + NH |
| 3 | à NH 3 Cl (arancio metilico) CH 3 |
| COOH + NaOHà CH | 3 COONa + H 2 O (fenolftaleina) |
| + | 4 + (Nessun indicatore adatto) COOH + NH Titolazione Redox: 2 KMnO 4 + 5 H 2 C 2 O |
4
+ 6 HCl → (+3) (+2) (+ 7) (+3) (+2) (+2) (+2) (+2) 4) Nella precedente reazione, il permanganato viene ridotto mentre l'ossalico viene ossidato. Una volta completata la reazione, il colore viola del permanganato cambia in incolore. KMnO 4 + 5FeCl 2 + 8HCl → 5FeCl 3 + MnCl 2 + KCl + 4H 2 O (+ 7) (+2) (+3) (+2)
Immagine gentile:
1. Titolazione di acido debole con forte base Da Quantumkinetics (lavoro personale) [CC BY 3. 0], tramite Wikimedia Commons
2. "Titolazione della titolazione precedente di Winkler" di Willwood [CC BY-SA 3. 0] via Commons




