Differenza tra Alkanes e Alkene | Alkanes vs Alkene
Differenza chiave - Alkanes vs Alkenes
Alkanes e alcheni sono due tipi di famiglie di idrocarburi che contengono carbonio e idrogeno nella loro struttura molecolare. La differenza fondamentale tra Alkan e Alcheni è la loro struttura chimica; gli alcani sono idrocarburi saturi con la formula molecolare generale di C n H 2n + 2 e gli alchenici sono considerati un gruppo idrocarburico insaturo poiché contengono un doppio legame tra due carbon atomi. Hanno la formula molecolare generale di C n H 2n.
Quali sono gli Alkanes?
Alkanes contengono solo legami singoli tra atomi di carbonio e idrogeno (legami C-C e legami C-H). Quindi sono chiamati "idrocarburi saturi". Secondo il modello di ibridazione orbitale, tutti gli atomi di carbonio in alceni hanno l'ibridazione SP 3 . Formano legami sigma con atomi di idrogeno, e la molecola risultante ha la geometria di un tetraedro. Gli Alkanes possono essere suddivisi in due gruppi secondo le loro strutture molecolari; (C n H 2n. +2 ) e alcani ciclici (C n H 2n ).

Che cosa sono gli alcheni?
Gli alcheni sono gli idrocarburi, contenenti un doppio legame carbonio-carbonio (C = C). "Olefine" è il vecchio nome usato per riferirsi alla famiglia di alchene. Il più piccolo membro di questa famiglia è l'etano (C 2 H 4 ); fu chiamato gas olefico (in latino: oleum significa 'olio' + 'facere' significa "fare") nei primi giorni. Ciò è dovuto al fatto che la reazione tra C 2 H 4 e Cloro dà C 2 H 2 Cl 2 olio.

Qual è la differenza tra Alkanes e Alcheni?
Struttura chimica di Alkanes e Alkene
Alkanes: Alkanes hanno la formula molecolare generale C n H 2n + 2. Metano (CH 4 ) è l'alcano più piccolo.
| Struttura aciclica | Metano | CH |
| 4 | CH 4 | Ethane |
| > C | 2 H 6 CH | 3 CH 3 propano |
| C | 3 H 8 CH | 3 CH 2 CH 3 butano |
| C | 4 H 10 CH 3 | CH 2 CH 2 CH 3 pentano C |
| 5 | H 12 CH 3 | CH 2 CH 2 CH 2 CH 3 Esano C |
| 6 H | 14 CH 3 CH | 2 CH 2 CH 2 CH 2 CH 3 Eptano C 7 |
| H | 16 CH 3 CH | 2 CH 2 CH 2 CH 2 CH 2 CH 3 Octane C 8 H |
| 18 | CH 3 CH 3 | CH 2 CH 2 CH 2 CH 2 3 CH 3 Alcheni: Gli alcheni hanno la formula chimica generale di C n H 2n .Gli alcheni sono considerati idrocarburi insaturi poiché non contengono il numero massimo di atomi di idrogeno posseduti da una molecola di idrocarburi. |
Nome Formula chimica Struttura Ethene C 2
| H | 4 | CH |
| 2 = | CH 2 Propene C | 3 H 6 CH |
| 3 | CH = CH 2 Butene C | 4 H 8 CH |
| 2 = | CHCH 2 CH 3, | CH 3 CH = CHCH 3 Pentene C 5 H 10 CH 2 = |
| CHCH | 2 CH 2 CH | 3 CH = CHCH 2 CH 3 Hexene C 6 H 12 CH 2 = CHCH 2 CH |
| 2 | CH 2 CH 3 | CH 3 CH = CHCH 2 CH 2 CH 3 CH 3 CH 2 CH = CHCH 2 CH 3
eptene C 7 H 14 CH = CHCH < 2 CH 2 |
| CH | 2 CH 2 CH | 3 CH 3 CH = CH < 2 CH 2 CH 2 CH 2 CH 3 Proprietà chimiche di Alkan e alcoli Alkanes: Reattività: Alkanes sono inerti a molti reagenti chimici. Ciò è dovuto al fatto che i legami carbon-carbonio (C-C) e carbonio-idrogeno (C-H) sono abbastanza forti poiché gli atomi di carbonio e idrogeno hanno quasi i medesimi valori di electronegativity. Pertanto, è molto difficile rompere i loro legami, a meno che non siano riscaldati a temperature abbastanza alte. Combustione: Gli Alkanes possono bruciare facilmente nell'aria. La reazione tra Alkanes con l'eccesso di ossigeno è chiamata "combustione". In questa reazione, gli alcani convertono in anidride carbonica (CO 2 ) e acqua. 2 2 n 2 nH |
2
2 2
9
10
+ 13/2 O 2 + 5H 2
O Acido di ossigeno di ossigeno di ossigeno di butano Le reazioni di combustione sono reazioni esotermiche (emettono calore). Di conseguenza, gli alcani vengono utilizzati come fonte di energia. Alcheni: Reattività: Gli alcheni reagiscono con l'idrogeno in presenza di un catalizzatore metallico finemente diviso per formare il corrispondente alcano. Il tasso di reazione è molto basso senza un catalizzatore. L'idrogenazione catalitica è utilizzata nell'industria alimentare per convertire gli olii vegetali liquidi in grasso semi-solido per produrre margarina e grassi di cottura solidi. Proprietà fisiche di Alkanes e Alkene Forme Alkanes: Alkanes esistono come gas, liquidi e solidi. Metano, etano, propano e butano sono gas a temperatura ambiente. Le strutture non equilibrate di esano, pentano e eptano sono liquidi. Alkanes che hanno un peso molecolare superiore sono solidi.
CH 4 a C 4 H 10 sono gas C 5 H 12
a C
17
H
36
sono liquidi e
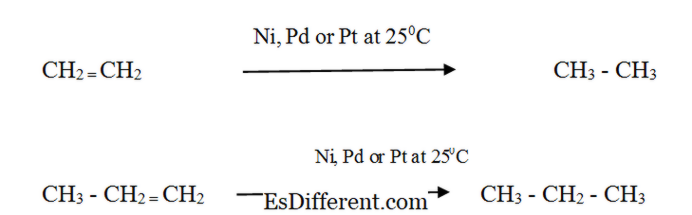
Alkanes con peso molecolare più elevato sono solidi morbidi
Alcheni:
Alcheni mostrano proprietà fisiche simili del corrispondente alcano. Gli alceni che hanno pesi molecolari inferiori (C
2 H
4 a 4 H 8 ) sono gas a temperatura ambiente e pressione atmosferica.Gli alceni aventi un peso molecolare superiore sono solidi. Solubilità:
Alkanes: Gli Alkanes non si dissolvono in acqua. Sono sciolti in solventi organici non polari o debolmente polari. Alcheni: Gli alceni sono molecole relativamente polari dovute al legame C = C; pertanto, sono solubili in solventi non polari o in solventi a bassa polarità. L'acqua è una molecola polare e gli alcheni sono leggermente solubili in acqua. Densità: Alkanes: Le densità di Alkanes sono inferiori alla densità dell'acqua. Il loro valore di densità è di circa 0. 7 g mL -1 , considerando la densità dell'acqua come 1. 0 g mL
-1
. Alcheni: Le densità degli alcheni sono inferiori alla densità dell'acqua. Punti di ebollizione: Alkanes: Il punto di ebollizione di alchene non equilibrate aumenta senza difficoltà aumentando il numero di atomi di carbonio e il peso molecolare. In generale, gli alcani ramificati hanno punti di ebollizione più bassi rispetto agli alcani non sfalsati, aventi lo stesso numero di atomi di carbonio. Alcheni : Punti di ebollizione sono simili agli alcani corrispondenti con una piccola variazione. Riferimenti: CliffsNotes. (n. d.). Estratto il 06 luglio 2016, da qui.
Proprietà fisiche di Alkanes. (2013). Estratto il 06 luglio 2016, da qui
Zum Directory-modus. (n. d.). Estratto il 06 luglio 2016, da qui Proprietà chimiche degli Alkanes: Wizznotes. com- Free GCSE e CXC: Tutorial, Documenti precedenti e Quiz. (n. d.). Estratto il 06 luglio 2016, da qui
Polarità. (n. d.). Estratto il 06 luglio 2016, da qui Dipole momenti. (2013). Estratto il 06 luglio 2016, da qui
Isomero strutturale. (n. d.). Estratto il 06 luglio 2016, da qui
Una introduzione agli alcheni. (n. d.). Recupero 06 luglio 2016, da qui Immagine per gentile concessione: "Nomi alkene" Di Chris Evans - (CC0) via Wikimedia Commons Wikizionario "C4-saturati idrocarburi ball-and-stick" Da Fvasconcellos - Public Domain) via Wikimedia Commedia




