Differenza tra equazione bilanciata e equazione ionica netta | Equazione bilanciata vs equazione ionica netta
Differenza chiave - Equazione bilanciata vs equazione ionica netta
Tutte le reazioni chimiche possono essere scritte come equazioni. I componenti di questa equazione comprendono i reagenti con i loro stati fisici, una freccia per mostrare la direzione della reazione ei prodotti di reazione con i loro stati fisici. Se ci sono stati particolari condizioni, vengono anche scritte brevemente sulla freccia. Se la reazione è in equilibrio, vengono utilizzate due frecce intermedie in direzioni opposte. Una equazione chimica può essere scritta in due modi: come equazione equilibrata o come equazione ionica netta. La differenza fondamentale tra equazione equilibrata e equazione ionica netta è che equazione equilibrata mostra tutte le reazioni avvenute in un sistema insieme mentre l'equazione ionica netta mostra solo la reazione netta che si è verificata dopo il completamento di quel particolare reazione.
SOMMARIO
1. Panoramica e differenza chiave
2. Che cos'è un'equazione bilanciata
3. Che cos'è un'equazione ionica netta
4. Confronto laterale - Equazione bilanciata vs equazione ionica netta
5. Sommario
Che cos'è un'equazione bilanciata?
Le reazioni chimiche sono molto importanti per comprendere il comportamento di un particolare sistema. Scrivendo l'equazione corretta per la reazione, si può avere un'idea sui cambiamenti di specie diverse in quel sistema. Per reazioni semplici come la dissoluzione di NaCl in acqua, l'equazione può essere scritta facilmente prevedendo i possibili prodotti di tale reazione. Ma per altre reazioni complesse, potrebbe essere necessario effettuare ulteriori prove per scoprire i prodotti di quel particolare sistema. Ma la maggior parte dei tempi, l'equazione scritta è molto probabile che sia sbilanciata, il che rende difficile spiegare il comportamento chimico di quel sistema. Pertanto, le equazioni sbilanciate dovrebbero essere equilibrate. L'equazione equilibrata include tutti i reagenti ei prodotti di quel sistema. L'equazione è scritta considerando il composto reagente come una molecola. Ad esempio, l'equazione equilibrata tra KI e PbNO 3 (se reagiti in acqua) sarebbe;

3 e KI dovrebbe essere 1: 2 quando si aggiungono tali componenti nel sistema. Che cos'è un'equazione ionica netta?
L'equazione ionica netta mostra solo la reazione globale che ha avuto luogo nel sistema. Include le specie ioniche e prodotti formati. Ma non indica tutte le reazioni avvenute in un particolare sistema. Ad esempio, se esiste una reazione tra due molecole che utilizzano acqua come mezzo, i composti possono essere disciolti in acqua e separati in ioni. Alcuni di questi ioni possono essere coinvolti nella reazione, ma alcuni potrebbero non essere. Allora l'equazione ionica netta include solo gli ioni che hanno partecipato ad una reazione netta. Altri ioni, chiamati ioni spettatori, vengono eliminati dall'equazione per ottenere l'equazione ionica netta. Ad esempio, se KI e PbNO
3 reagirono in acqua, sarebbe la reazione ionica netta; Questo dovrebbe includere anche ioni K
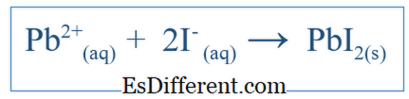
ion e NO3 - , ma questi ioni si dissolveranno e non partecipano alla reazione maggiore; quindi, non sono inclusi nella reazione ionica netta. Qual è la differenza tra l'equazione bilanciata e l'equazione ionica netta? - differenza articolo prima della tabella ->
Equazione bilanciata vs equazione ionica netta
Tutti i componenti utilizzati sono scritti come i reagenti nell'equazione equilibrata.
Reattivi che sono stati coinvolti solo nella reazione netta sarebbero scritti nella reazione ionica netta. |
|
| Products | Tutti i componenti alla fine della reazione sono inclusi in un'equazione equilibrata. |
| In un'equazione ionica netta, viene scritto solo il prodotto finale netto. | |
| Dettagli dato | L'equazione equilibrata fornirà dettagli su tutte le specie presenti nel sistema. |
| L'equazione ionica netta fornisce dettagli solo sulle specie che hanno partecipato alla reazione | |
| Sommario - equazione bilanciata vs equazione ionica netta | Quando alcuni composti ionici vengono aggiunti all'acqua, si rompono e formano ioni sciolti in acqua. Questo produce anioni e cationi. Per mostrare le specie prodotte dopo il completamento della reazione e la direzione della reazione, può essere scritta un'equazione chimica. Questa equazione può essere bilanciata considerando il numero di atomi di ogni specie che risiedono sui due lati della freccia; a volte, anche la carica di queste specie dovrebbe essere considerata. Questo dà un'equazione chimica equilibrata per quel particolare sistema. Tuttavia, l'equazione ionica netta include solo le specie reagite. Come indicato in precedenza, la differenza fondamentale tra equazione equilibrata e equazione ionica netta è che l'equazione equilibrata mostra tutte le reazioni in un sistema, mentre l'equazione ionica netta mostra solo la reazione netta che si è verificata al termine della reazione particolare. |
Riferimenti:
1. Chang, R., 2010. chimica. 10 ° ed. NewYork: McGraw-Hill.
2. Reazioni chimiche. (n. d.). Estratto il 26 maggio 2017, da // www. ric. edu / docenti / ptiskus / reazioni /
3. Completi equazioni ioniche e nette ioniche. (n. d.). Recuperato il 26 maggio 2017, da // www. Khan Academy. org / scienza / chimica / chimiche reazioni-stoichiome / tipi-di-chimico-reazioni / a / completo-ionici e-net-ionici equazione.


