Differenza tra la combinazione e la reazione di decomposizione | Combinazione vs Reazione di Decomposizione
Differenza chiave - Combinazione / Reazione di Decomposizione Una reazione chimica è la conversione di uno o più composti chimici in una o più reazioni di reazione di reazione diversi prodotti, cambiando l'identità di un composto chimico. Il materiale di partenza di una reazione chimica è chiamato il reagente e il composto risultante è chiamato il prodotto. La rottura dei composti o la combinazione di composti e la formazione di nuovi composti si verificheranno durante un processo di reazione chimica poiché i legami tra atomi del composto sono rotti e creati in modo diverso. Le reazioni chimiche possono essere suddivise in diverse categorie. Reazioni redox o reazioni di riduzione dell'ossidazione sono molto importanti tra loro. Le reazioni di ossidazione e riduzione sono chiamate reazioni di trasferimento di elettroni, poiché gli elettroni dei reagenti vengono trasferiti da un composto all'altro per causare la reazione. Nelle reazioni redox si verificano contemporaneamente due reazioni parallele, chiamate mezze reazioni. Queste metà reazioni mostrano il trasferimento di elettroni. Equilibrando queste mezze reazioni, si può immaginare la reazione globale che è avvenuta alla fine. Le reazioni combinate e le reazioni di decomposizione sono due tipi principali di reazioni redox. La principale differenza tra la combinazione e la reazione di decomposizione è che la reazione combinata comporta una combinazione di reagenti per dare un unico prodotto mentre la reazione di decomposizione comporta la ripartizione di un singolo composto in due o più prodotti.
SOMMARIO
1. Panoramica e differenza chiave
2. Che cosa è una reazione combinata
3. Che cosa è una reazione di decomposizione
4. Confronto Side By Side - Combinazione vs Reazione di Decomposizione
5. Riepilogo
Che cos'è una reazione combinata?
Una reazione di combinazione, chiamata anche come reazione di sintesi , è una reazione in cui i composti reagenti vengono combinati per formare un composto differente come il prodotto. In altre parole, la reazione di molecole semplici provoca una molecola complessa. Alcuni o tutti i legami tra gli atomi di quel particolare composto sono suddivisi; allo stesso tempo, gli atomi si uniscono per formare il nuovo composto, che è il prodotto. Nelle reazioni di decomposizione, lo stesso reagente agisce come il materiale di partenza per entrambe le mezze reazioni.A differenza delle reazioni di decomposizione, le mezze reazioni nelle reazioni combinate hanno diversi reagenti per cominciare. La reazione di combinazione produce un unico prodotto. Di seguito è riportato un esempio comune che può essere dato come reazioni di combustione.
Ad esempio, quando l'alluminio (Al) viene posto in bromuro liquido (Br2 ) si verifica una reazione combinata e produce bromuro di alluminio (AlBr 3 ). Qui il numero di ossidazione è aumentato in Al e diminuito in Br. Pertanto, è una reazione redox ed è una reazione combinata poiché due reagenti hanno reagito per dare un particolare prodotto. Figura 01: Reazione combinata
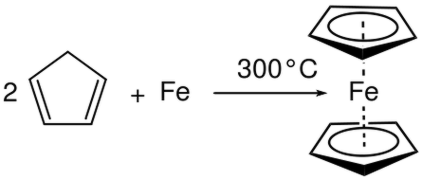
La reazione di decomposizione è un'altra importante reazione nella categoria delle reazioni redox. È fondamentalmente l'opposto della reazione combinata. Una reazione di decomposizione è una reazione in cui il composto reagente è suddiviso in prodotti. Qui, le mezze reazioni si verificano contemporaneamente alla reazione di ossidazione e alla reazione di riduzione. Ma a differenza della reazione combinata, il reagente per entrambe le mezze reazioni è lo stesso nelle reazioni di decomposizione. La reazione di decomposizione produce diversi prodotti.
Nell'elettrolisi dell'acqua, quando la corrente continua viene passata attraverso l'acqua, le molecole d'acqua vengono decomposte per dare gas di ossigeno e idrogeno. Qui il numero di ossidazione è aumentato nell'atomo di ossigeno e diminuisce nell'atomo di idrogeno. Quindi, è una reazione redox e una reazione di decomposizione a causa della rottura delle molecole d'acqua in ossigeno e gas di idrogeno.
Figura 02: Combinazione vs Decomposizione

Qual è la differenza tra la Combinazione e la Decomposizione Reazione?
- differenza Articolo prima della tabella ->
Combinazione vs reazione di decomposizione
Due o più composti reattivi sono coinvolti nelle reazioni combinate. |
|
| Un composto singolo è coinvolto in una reazione di decomposizione. | Prodotti |
| La reazione di combinazione produce un singolo prodotto. | |
| Le reazioni di decomposizione producono diversi prodotti. | Half Reactions |
| In reazioni combinate, due metà reazioni hanno due diverse molecole di partenza. | |
| In reazioni di decomposizione, una singola molecola agisce come materiale di partenza per entrambe le mezze reazioni. | Bondine chimiche |
| Le reazioni combinate provocano l'incollaggio di atomi per produrre il prodotto finale unico. | |
| In reazioni di decomposizione, i legami chimici sono suddivisi per formare due o più prodotti finali. | Molecole |
| Le reazioni combinate causano le molecole semplici a reagire e produrre molecole complesse. | |
| Le reazioni di decomposizione causano molecole complesse a rompersi in molecole semplici. | Sommario - Combinazione / Reazione di Decomposizione |
Le reazioni redox sono molto parte del mondo intorno a noi perché la maggior parte delle reazioni chimiche importanti sono reazioni redox. Le reazioni combinate e le reazioni di decomposizione sono reazioni semplici che si oppongono l'una all'altra. La principale differenza tra la combinazione e la reazione di decomposizione è che la reazione di combinazione comporta la combinazione di due o più molecole reagenti per produrre un unico prodotto finale mentre la reazione di decomposizione comporta la rottura di una singola molecola in due o più prodotti.
Riferimenti:
1. Chang, R., 2010. chimica. 10 ° ed. NewYork: McGraw-Hill.
2. Redox. (2009, 30 luglio). Estratto il 29 maggio 2017 da // weakinteractions. wordpress. com / primer / redox /
3. Le reazioni. (n. d.). Estratto il 29 maggio 2017, da // www. ric. edu / faculty / ptiskus / reactions /
Immagine per gentile concessione:
1. "Miller Ferrocen Synthese" di Bert. Kilanowski - Il proprio lavoro (CC0) via Wikimedia Commedia
2. "Reazioni chimiche" di Daniele Pugliesi - Il lavoro personale (CC BY-SA 3. 0) via Wikimedia Commedia [Cropped]


