Differenza tra Octet e Duplet | Octet vs Duplet
Differenza chiave - Octet vs Duplet
Ci sono atomi o composti chimici attivi e inattivi presenti nella natura. Questa caratteristica è prevalentemente dipendente dal numero di elettroni presenti nei gusci più esterni degli atomi. Atomi con gusci incompleti possono diventare attivi per completare la loro configurazione di elettroni per diventare stabili. Gli atomi inattivi hanno una configurazione completa di elettroni; quindi, questi atomi non reagiscono con nessun altro atto, a meno che in condizioni particolari. I gas nobili sono sempre inattivi in natura. Quindi, sono conosciuti come gas inerti. I gas inerti sono nell'ottava colonna della tabella periodica. Altri elementi dello stesso periodo (fila) tendono ad ottenere la configurazione elettronica del gas inerte alla fine di quel periodo, che è la forma più stabile in natura. Gli atomi attivi tendono a completare il numero di elettroni secondo la regola octetica o la regola dupleta . La differenza fondamentale tra ottetto e duplice è che l'ottetto è un atomo o uno ione con un massimo di otto elettroni nel guscio più esterno mentre duplet è un atomo avente il massimo di due elettroni nel guscio più esterno.
SOMMARIO1. Panoramica e differenza chiave
2. Che cosa è un Octet
3. Che cosa è un Duplet
4. Confronto laterale - Octet vs Duplet
5. Sommario
Che cos'è un Octet?
Un ottetto è un atomo o un ione che ha otto elettroni nel guscio più esterno dell'atomo. Tutti i gas nobili ad eccezione dell'elio hanno otto elettroni e sono inerti in natura. La configurazione elettronica di un nobile gas finisce sempre come segue.
Per esempio, la configurazione elettronica di Neon è di 1s
22s 2 ns 2
2p 6 . Il neon è un gas inerte. Altri elementi che dispongono di elettroni da sette, sei, eccetera nell'orbitale più esterno tendono ad obbedire alla norma ottettica ottenendo elettroni dall'esterno; alcuni altri elementi dotati di elettroni da uno, due, ecc. tendono a perdere elettroni e ottenere la configurazione elettronica del più vicino gas inerte. Ma altri elementi al centro della tavola periodica formano nuovi legami con elementi che hanno elettroni in eccesso per condividere quegli elettroni e diventare un ottetto.
Atomo di idrogeno e atomo di elio sono gli elementi più piccoli della natura e hanno solo un orbitale attorno al loro nucleo. Questo orbita è chiamato orbita 1s. Questo orbito può contenere un massimo di due elettroni. L'atomo di idrogeno ha un elettrone e l'elio ha due elettroni. Quindi, l'elio viene chiamato duplice.L'elio ha il numero massimo di elettroni che può avere; quindi è un elemento stabile nella natura. Pertanto, l'elio è anche un gas inerte. Ma l'idrogeno ha solo un elettrone e l'unico orbitale che ha è incompleta. Così, l'atomo di idrogeno da solo è molto reattivo e tende a formare un legame covalente con un altro atomo di idrogeno condividendo gli unici elettroni che hanno. Poi questi atomi di idrogeno diventano dupleti poichè ora dispongono di due elettroni nei loro orbitali più esterni. Ma il litio può anche comportarsi come duplice rimuovendo l'elettrone dal suo orbitale più esterno. La configurazione elettronica del litio è di 1s
2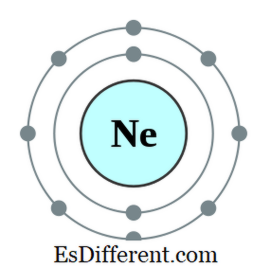
2s
1
. Rimuovendo l'elettrone 2s 1 , può diventare un duplice. In questo caso, He, H - e Li + sono dupleti che possono esistere come dupleti stabili. Tutti i dupleti hanno configurazione elettronica che termina come segue. ns 2 Figura 02: Elio, un duplice
Qual è la differenza tra Octet e Duplet?
- diff Article Middle before Table -> Octet vs Duplet

L'ottetto ha otto elettroni nella shell più esterna.
Duplet ha due elettroni nella shell più esterna.
La configurazione comune dell'elettronica
L'ottetto ha ns |
|
| 2 | np |
| 6 | |
| configura l'elettronica alla fine. Duplet ha ns 2 configura tipo alla fine. Numero di orbitali | L'ottetto può avere un minimo di due orbitali. Un duplice ha solo un orbitale. Tipo di orbitali |
| Un ottetto può avere tutti i tipi di orbitali come s, p, d, f, ecc. | |
| Duplet ha solo orbitale. | Sommario - Octet vs Duplet |
| Tutti gli elementi tendono a diventare stabili. Ma con configurazioni elettroniche incomplete, gli atomi non possono essere stabili; così diventano molto reattivi per riempire le conchiglie con elettroni guadagnando, perdendo o condividendo gli elettroni. Gli atomi o le molecole che rispettano l'ottetto o la doppia regola sono stabili. La differenza fondamentale tra ottetto e duplice è che l'ottetto ha otto elettroni nel suo orbitale più esterno mentre il duplet ha due elettroni nel suo orbitale. | |
| Riferimenti: | 1. Nema, P., 2011. Topperlearning. [Online] Disponibile a: // www. topperlearning. com / forums / home-work-help-19 / what-is-octet-duplet-valenza-e-ioni-chimica-struttura-dell'atomo-46317 / risposta [Accesso 29 05 2017]. |
2. Chang, R., 2010. Chimica. 10 ° ed. New York: McGraw-Hill.
3. Anon., 2015. Stacker di gradi. [Online] Disponibile a: // gradestack. com / NTSE-Corso completo / Chemical-Bonding / Chemical-Activity-of-An / 19176-3853-37737-studio-wtw [Accesso 29 05 2017].
Immagine gentile:
1. "Elettron shell 002 Helium - no label" Da Pumbaa (opera originale di Greg Robson) - Schemi di shell elettronici (versione corrispondente etichettata) (CC BY-SA 2. 0 uk) via Commons Wikimedia
2. "Electron shell 010 Neon" di Pumbaa (opera originale di Greg Robson) (CC BY-SA 2. 0 uk) via Commons Wikimedia




